大面积骨缺损的治疗一直是骨科领域的硬骨头,术后感染率高达30%,传统的抗生素疗法不仅易催生耐药菌,还会抑制骨愈合,让患者和医生都头疼不已。值得注意的是,人体自身的免疫系统在骨修复的过程中发挥着重要作用,而巨噬细胞是其中最值得关注的双刃剑,其作用过程中的 “抗菌”与“修复”的时空矛盾,让传统静态材料顾此失彼。因此,开发能“按需切换”免疫模式的“可编程”生物材料,成为突破这一瓶颈的关键所在。
近日,济南大学前沿交叉科学研究院孙春辉教授、刘宏教授与山东大学齐鲁医院刘超教授合作,瞄准了这一空白,创新性地提出将羟基磷灰石(HAp)纳米棒与MXene纳米片复合合成了HAp@MXene纳米颗粒,通过体外磁场的介入实现了“早期强效抗菌、后期高效修复”的程序性免疫调控,利用双材料协同、双机制联动的设计,将材料的“被动作用”升级为“主动调控”,通过简单的磁场作用就能实现在巨噬细胞M1/M2极化间精准切换,这破解感染性骨缺损治疗的困境提供了全新的思路。研究成果以“Programmatic Regulation of Macrophage Polarization by HAp@MXene Nanocomposites to Promote Bone Repair”为题发表在国际期刊BMEMat。文章第一作者为济南大学前沿交叉科学研究院2022级硕士崔来森和黄海娜,文章通讯作者为济南大学前沿交叉科学研究院孙春辉教授和刘宏教授、山东大学齐鲁医院刘超教授与中国海洋大学海洋生命学院刘雅教授。原文链接:https://onlinelibrary.wiley.com/doi/10.1002/bmm2.70034
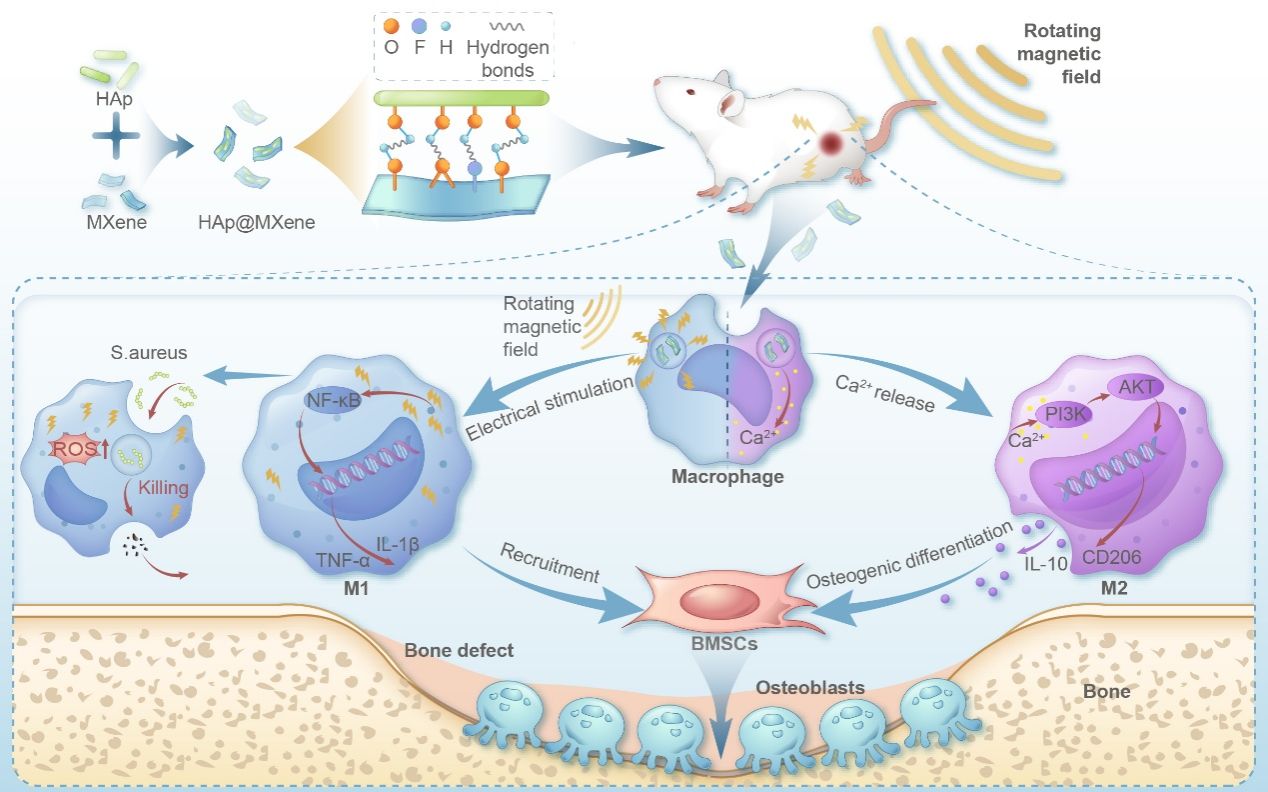
图 1 . HAp@MXene调控巨噬细胞极化促进骨修复机制图
主要内容
1.HAp@MXene的制备与生物相容性验证
研究团队成功合成了HAp@MXene纳米复合材料,其具有良好的细胞相容性,且能够在磁场作用下产生感应电压,证实了其磁电效应。此外,验证了材料在酸性环境下(溶酶体)的钙离子释放能力,为后续的细胞实验提供了理论基础。
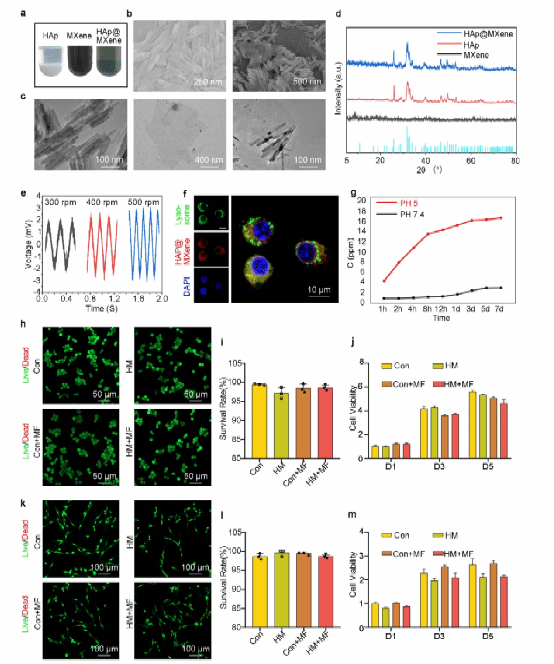
图 2 . HAp@MXene的表征
2.HAp@MXene程序性调控巨噬细胞极化
图3揭示了HAp@MXene对巨噬细胞极化的动态调控:在磁场作用下,巨噬细胞表现出M1极化特征(高表达TNF-α、IL-1β和iNOS),去除磁场后,巨噬细胞转向M2极化(高表达IL-10、CD206和Arg-1)。这一结果在mRNA和蛋白水平均得到验证,表明HAp@MXene可通过磁场精准调控巨噬细胞极化,证明了利用纳米材料配合磁场影响巨噬细胞表型,前期M1促进炎症反应,后期M2抗炎并促进骨细胞增殖分化,时序调控巨噬细胞极化参与组织再生的可行性,这为骨修复中的免疫微环境调控提供了有力工具。
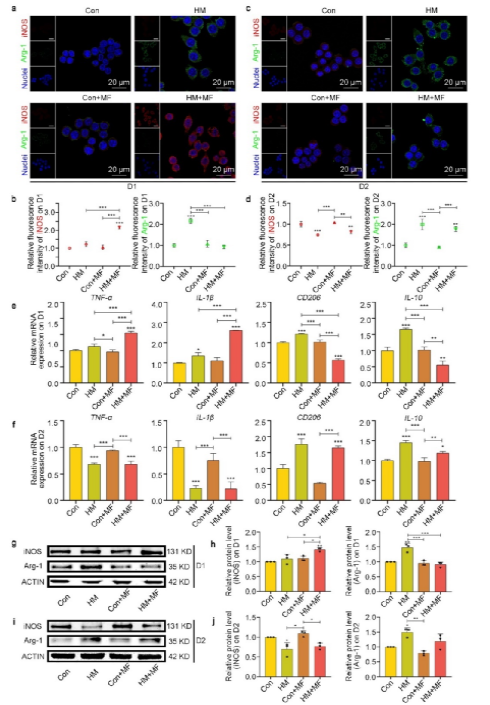
图 3 . 巨噬细胞的程序性极化
3. HAp@MXene促进成骨分化
接下来评估了HAp@MXene对MSCs成骨分化的影响。结果显示,HAp@MXene显著提高了成骨相关蛋白(OPN、OCN)的表达,以及Runx2、Col-1、OPN和BMP-2等成骨相关基因的表达,表明HAp@MXene对间充质干细胞的成骨分化具有极佳的促进作用,加速骨组织再生,而转磁处理对间充质干细胞的成骨分化无显著影响。
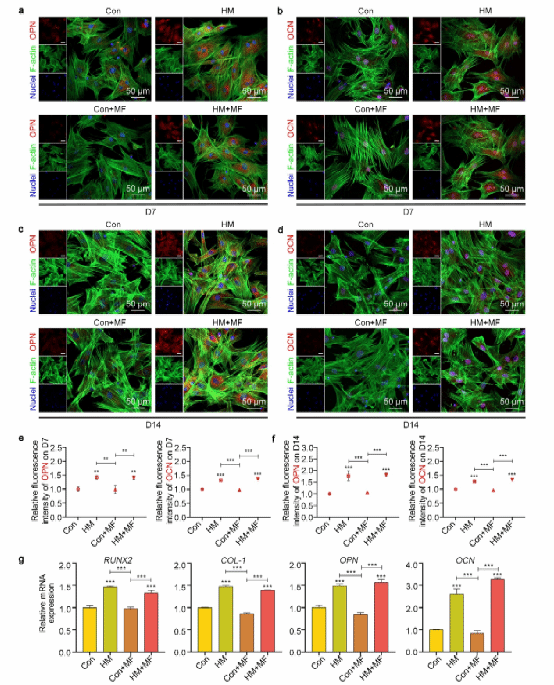
图 4 . HAp@MXene促进成骨分化
4. HAp@MXene诱导的巨噬细胞M1极化增强抗菌能力
在本研究的设计中,前期材料加旋转磁场诱导巨噬细胞向M1方向极化,除了募集干细胞前往损伤部位进行修复,还有更重要的杀灭细菌的目的。因此,对HAp@MXene在磁场作用下通过诱导巨噬细胞M1极化增强抗菌能力的效果进行验证,结果显示,材料加转磁组的巨噬细胞表现出更高的细菌吞噬效率和更低的活菌数量,同时细胞内ROS水平显著增加,表明HAp@MXene能有效增强巨噬细胞的抗菌能力。
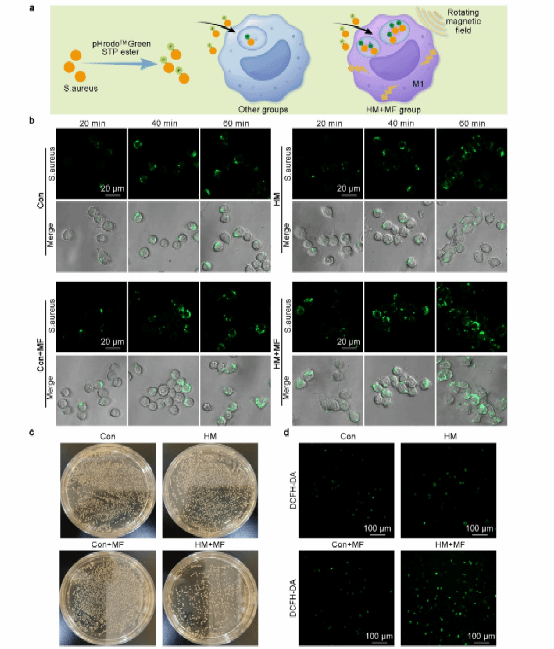
图 5 . 巨噬细胞M1极化增强抗菌能力
5. HAp@MXene诱导的巨噬细胞M2极化促进成骨分化
为验证M2巨噬细胞协同材料促进成骨的作用,在transwell系统中对RAW 264.7和MSCs进行共培养,实验分为四组:Control组(不添加材料);A组(上室内添加材料);B组(下室内添加材料);C组(上室和下室均添加材料)。A组和C组的上室添加材料后,巨噬细胞朝M2方向极化,与Control组和B组的M0巨噬细胞形成对比,实验结果表明,M2极化的巨噬细胞分泌的因子显著促进了MSCs的成骨分化,表现为OPN、OCN等成骨标志物的高表达,进一步证实了HAp@MXene在骨修复中的协同作用。
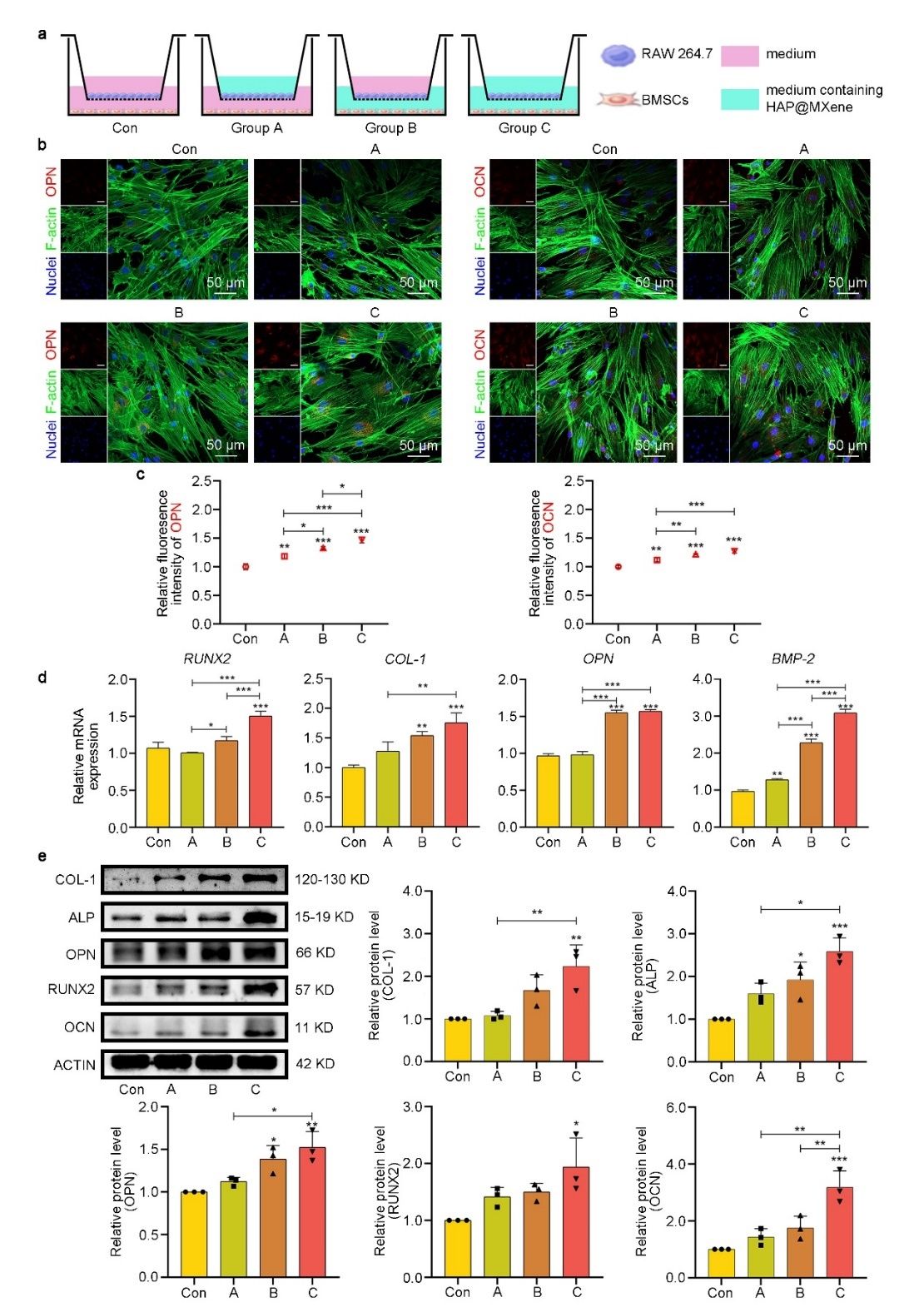
图 6 . 巨噬细胞M2极化促进成骨分化
6. HAp@MXene调控巨噬细胞极化的分子机制
在本研究中,研究团队采用高通量测序技术深入分析了电刺激对巨噬细胞极化状态的影响,为材料的免疫调节机制提供了分子层面的解释。RNA测序和KEGG分析表明,在旋转磁场下,HAp@MXene表面产生的无线电刺激能够通过激活NF-κB通路,促进巨噬细胞M1型极化,从而增强其免疫调节功能,在没有施加磁场作用时,HAp@MXene在细胞内释放的Ca2+可以激活PI3K-Akt通路,进而促进巨噬细胞向M2方向极化,这一发现不仅揭示了HAp@MXene在免疫调节中的潜在作用,而且为新型免疫调节材料的开发提供了新的策略。
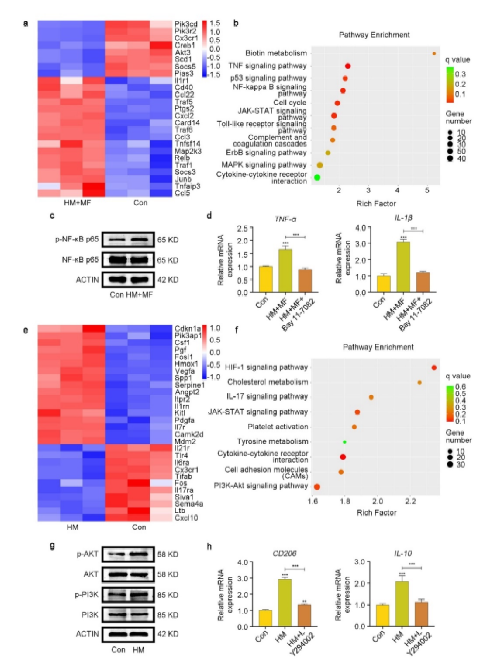
图 7 . 巨噬细胞极化的分子机制解析
7. HAp@MXene在皮下感染模型中的免疫调节抗菌性能
为验证材料植入体内后,在旋转磁场下产生的电信号可以增强处理部位的炎症反应,提高细菌抵抗能力,研究团队设计了大鼠皮下感染模型以评估其作用。实验表明,HAp@MXene在磁场作用下显著降低了脓肿组织中的细菌负荷,减轻了炎症反应。这表明HAp@MXene通过诱导巨噬细胞M1极化,增强了抗菌能力,为骨缺损修复中的感染防控提供了有力支持。
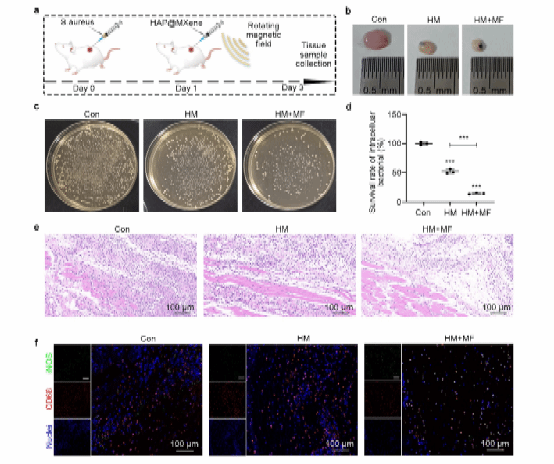
图 8 . HAp@MXene介导的免疫调节抗菌性能分析
8. HAp@MXene在股骨缺损模型中的骨修复效果
为了进一步证实HAP@MXene在骨组织再生过程中的骨免疫调节作用,研究团队使用大鼠股骨缺损模型来评估复合纳米颗粒在体内的作用。结果显示,材料加转磁组的新骨形成程度最大,缺损愈合程度最高,且加入材料后周围组织内的巨噬细胞M2极化标记物Arg-1表达量明显高于Control组,说明材料在骨缺损模型的局部微环境中诱导巨噬细胞M2极化,促进组织的修复进程。实验表明,HAP@MXene纳米复合材料可以在体内环境下,通过材料作用与免疫调节,协调促进成骨细胞分化,加速骨缺损修复。植入材料初期,外部磁场诱导巨噬细胞M1极化,加速了缺损部位对干细胞的募集速度,为随后的干细胞分化奠定基础,撤除磁场刺激后,材料同时诱导巨噬细胞M2极化间充质干细胞成骨分化,极大的促进了骨缺损修复。
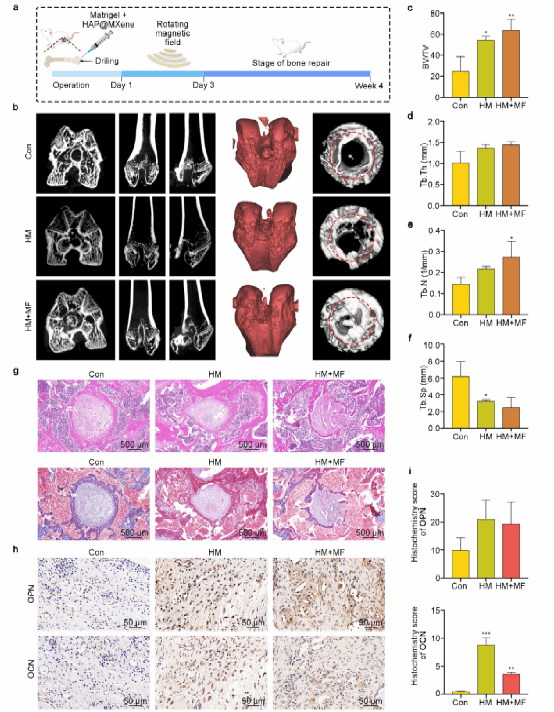
图 9 . HAp@MXene介导的骨损伤修复