济南大学于欣、王爱珠团队与瑞典查尔姆斯理工大学Ivan Mijakovic教授Advanced Functional Materials: 界面工程调控的C3N4/TiN异质结构用于光催化/酶催化的协同抗感染治疗

细菌感染,尤其是由耐药菌引起的皮肤及创面感染,已成为当前临床治疗中亟待解决的重大难题。传统抗生素依赖特定分子靶点发挥作用,易诱导细菌产生耐药性,在复杂感染微环境(如高生物负载、缺氧或炎症条件)下治疗效果显著受限。因此,发展不依赖抗生素、具有广谱高效杀菌能力且耐药风险低的新型抗菌治疗策略,是抗感染研究领域的核心科学问题之一。
纳米酶作为一类人工酶材料,为高效ROS生成提供了新的研究范式。济南大学于欣团队长期致力于过渡金属氮化物纳米酶的系统研究,揭示了其在抗菌催化中的独特优势。过渡金属氮化物纳米酶具有高导电性和接近金属态的电子结构,有利于电子在催化反应过程中的快速迁移,从而显著提升类酶反应动力学。同时,氮原子较低的电负性能够有效调控过渡金属中心的局域电子结构,降低反应能垒,显著增强其类过氧化物酶(POD-like)活性。基于上述认识,研究团队采用高温氨气氛围下的原位氮化策略,成功实现了金属前驱体向氮化物的可控转化,制备了 TiN(Angew. Chem. Int. Ed. 2021, 60, 25328–25338)和 WN(ACS Nano 2024, 18, 35, 24469–24483)纳米酶。所得材料在保持纳米尺度结构特征的同时,其类 POD 活性和 ROS 生成能力均得到显著提升。然而,单一过渡金属氮化物纳米酶体系对可见光响应能力有限,主要依赖 H2O2触发的类酶反应,其ROS生成效率和作用范围易受底物扩散和界面接触效率限制,难以满足复杂感染环境中对高效、可控抗菌治疗的实际需求。针对上述瓶颈,将纳米酶催化与光催化过程进行协同整合,被认为是实现高效抗菌治疗的重要发展方向。
基于此,济南大学于欣、王爱珠研究团队联合瑞典查尔姆斯理工大学Ivan Mijakovic教授,构建了一种C3N4/TiN异质结构,通过原位限域将超小尺寸TiN纳米颗粒均匀负载于二维C3N4纳米片表面。界面限域效应不仅提升了材料的结构稳定性和比表面积,还诱导电荷重新分布,形成有利于载流子迁移的内建电场,同时结合TiN的表面等离子体共振(SPR)效应显著增强可见光吸收。该异质结构同时具备光催化活性和类POD活性,实现了光催化与纳米酶催化的深度协同,从而显著放大ROS的生成效率。通过对TiN负载量的优化,有效避免了界面遮蔽问题。基于上述结构与功能优势,本研究系统阐明了C3N4/TiN异质结构在光催化与纳米酶活性协同增强中的作用机制,并在体外耐药菌模型及体内MRSA感染小鼠皮肤模型中验证了其优异的抗菌性能、生物安全性和创面愈合促进效果。总体而言,本工作构建了一种高性能、可规模化的光催化–纳米酶协同抗菌平台,为异质结构材料在抗菌治疗与感染控制中的应用提供了新的机制认识与设计策略。
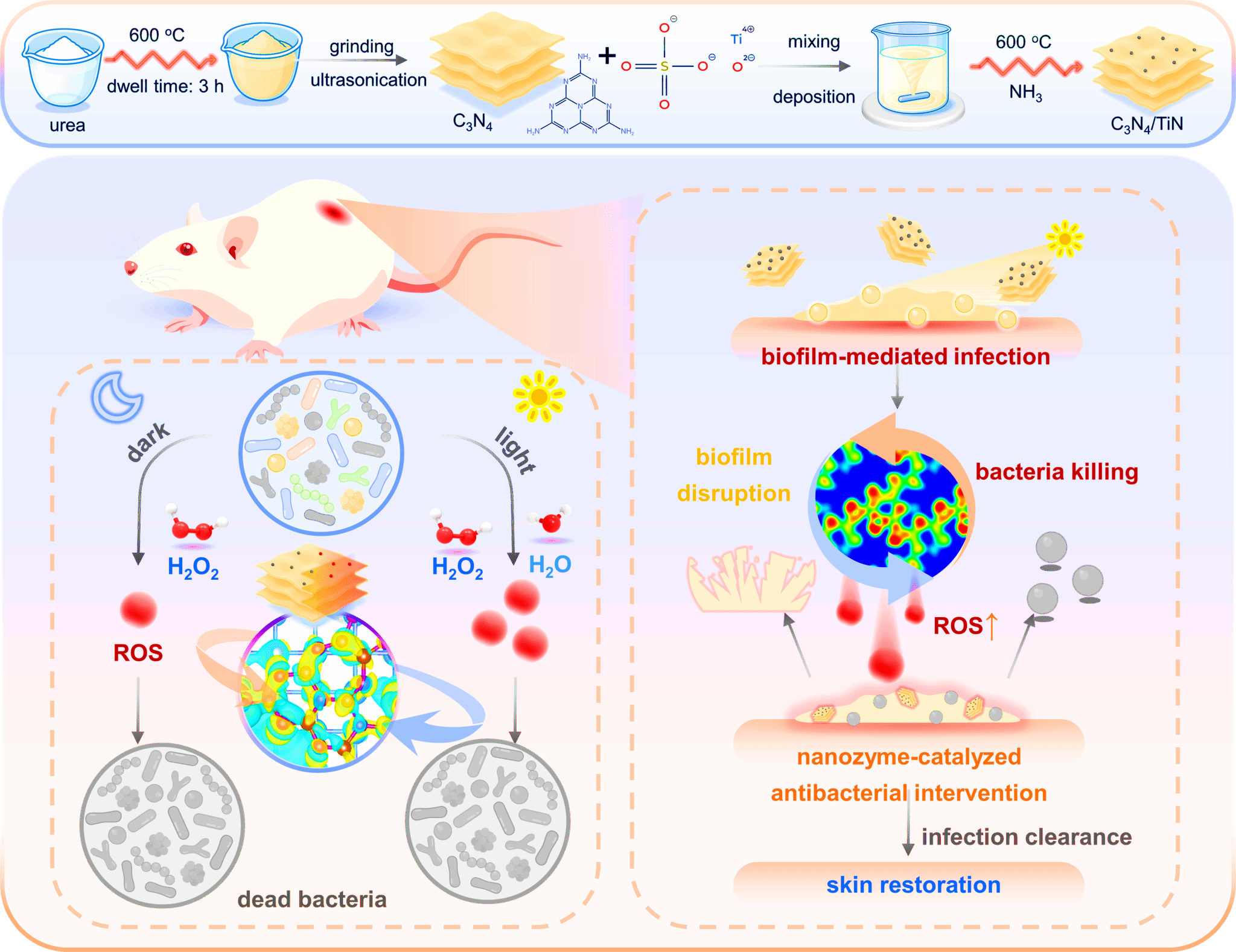
研究成果以“Interface-Engineered C3N4/TiN Heterostructures for Synergistic Photocatalytic-Nanozyme ROS Generation and Anti-Infective Therapy”发表在了国际权威期刊Advanced Functional Materials上,通讯作者是济南大学于欣教授、王爱珠副教授与瑞典查尔姆斯理工大学Ivan Mijakovic教授,滨州医学院的王龙伟教授。上述研究工作的得到了国家自然科学基金、山东省自然科学基金、山东省泰山学者基金等计划的支持。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adfm.202532083